離子交換層析(色譜) 一、原理
離子交換層析(Ion exchange chromatography, IEC)是利用離子交換劑為固定相,根據荷電溶質與離子交換劑之間靜電相互作用力的差別進行溶質分離的層析法。
荷電溶質在離子交換劑上的分配系數可用下式表示:
I — 流動相的離子強度,A和B為常數, 為離子強度無限大時溶質的分配系數,是靜電相互作用以外的非特異性吸附引起的溶質在離子交換劑上的分配。 離子交換基: 陰離子:DEAE(二乙胺乙基); QAE(季胺乙基) 陽離子:CM(羧甲基);SP(磺丙基)
對于蛋白質等兩性電解質,在物理意義上,B為溶質的靜電荷數與離子價數之比。在pH偏離等電點的溶液中,蛋白質溶質的靜電數常為兩位數以上,故B值較大,即蛋白質的分配系數對離子強度非常敏感。在同一離子強度下,不同蛋白質的分配系數相差非常大(幾個數量級)。 洗脫方式:
恒定洗脫法:洗脫液(流動相)的離子強度不變;
缺點:對于在吸附柱上分配系數相差較大的蛋白質很難實現很好的分離。 線性梯度洗脫法或階段梯度洗脫法:
除GFC以外的層析操作均采用此種方法。
在洗脫過程中,流動相的離子強度線性增大或階段梯度增大,因此溶質的分配系數連續(xù)降低,移動速度逐漸增大,使恒定洗脫條件下難于脫附的溶質得到洗脫。 線性梯度洗脫和階段梯度洗脫法的優(yōu)缺點如下: (1)線性梯度洗脫法:
優(yōu)點:流動相離子強度(鹽濃度)連續(xù)增大,不出現干擾峰,操作范圍廣; 缺點:需要特殊的調配濃度梯度的設備。 (2)階段梯度洗脫法:
優(yōu)點:利用切換不同鹽濃度的流動相溶液進行洗 脫,不需要特殊梯度設備,操作簡單; 缺點:因為流動相濃度不連續(xù)變化,容易出現干擾峰。
此外,容易出現多組分洗脫峰重疊的現象,因此洗脫操作參數(如鹽濃度體積)的設計較困難。 離子交換(IEC)的應用及特點
GFC — 主要用于產物的初步純化和中后期脫鹽
IEC — 是蛋白質、肽和核酸等生物產物的主要純化手段 IEC分離的特點:
(1)料液處理量大,具有濃縮作用,可在較高流速下操作;
(2)應用范圍廣泛,優(yōu)化操作條件可大幅度提高分離的選擇性,所需柱長較短; (3)產品回收率高;
(4)商品化的離子交換劑種類多,選擇余地大,價格也遠低于親合吸附劑。
疏水作用層析(色譜) 一、原理
疏水作用層析(Hydrophobic interaction chromatography, HIC)是利用表面偶聯弱疏水性基團的疏水吸附劑為固定相,根據蛋白質與疏水性吸附劑之間的弱疏水性相互作用的差別進行蛋白質類生物大分子分離純化的洗脫層析法。
二、疏水性吸附劑:將下表所列的各種凝膠過濾介質偶聯上疏水性配基后均可用作疏水性吸附劑。
常用的疏水性配基:苯基、短鏈烷基(C3~C8)、烷氨基、聚乙二醇和聚醚等。 吸附特點:
疏水性吸附作用的大小與配基的疏水性(疏水鏈長度)和配基密度成正比,故配基修飾密度應根據配基的疏水性而異,疏水性高的配基較疏水性低的配基修飾密度低。一般配基修飾密度在10 ~ 40?mol/ml,配基修飾密度過小則疏水性吸附不足,密度過大則洗脫困難。
三、HIC操作
上樣及洗脫的一般規(guī)律:
在高鹽濃度條件下,蛋白質與固定相疏水締合;濃度降低時,疏水作用減弱,逐步被洗脫下來。一般用pH 6-8的鹽水溶液[如(NH4)2SO4]。鹽的濃度影響蛋白質的疏水性,從而影響蛋白質的保留值。
鹽:Na2SO4,KH2PO4,NaHPO4,(NH4)2SO4,NH4OAc,KOAc,NaOAc,NaCl --〉 鹽析作用增強 《-- 洗脫能力增強
1、影響疏水性吸附的因素 蛋白質的疏水性與其荷電性質相比復雜得多,不易定量掌握。除疏水性吸附劑的性質(疏水性配基的結構和修飾密度)外,流動相的組成以及操作溫度對蛋白質疏水性吸附的強弱均產生重要影響。
(1)離子強度及種類 蛋白質的疏水性吸附作用隨離子強度提高而增大。離子的種類亦影響蛋白質的疏水性吸附。疏水性吸附與鹽析沉淀一樣,在高價陰離子的存在下作用力較高。因此HIC分離過程中主要利用硫酸銨、硫酸鈉和氯化鈉等鹽溶液為流動相,在略低于鹽析點的鹽濃度下進料,然后逐漸降低流動相離子強度進行洗脫分離。 (2)破壞水化作用的物質
, ,和 等離子半徑較大、電荷密度低的陰離子可減弱水分子之間相互作用。這類陰離子與上述鹽析作用強的高價陰離子(如 , 等)的作用正好相反,前者稱為離液離子(chaotropic ion),后者稱為反離液離子(antichaotropic ion)。在離液離子存在下疏水性吸附減弱,蛋白質易于洗脫。 #p#分頁標題#e#
除離液離子外,乙二醇和丙三醇等含羥基的物質也具有影響水化的作用,降低蛋白質的疏水性吸附作用,經常用做洗脫促進劑,洗脫疏水吸附強烈、僅靠降低鹽濃度難于洗脫的高疏水性蛋白質。
(3)表面活性劑 表面活性劑可與吸附劑及蛋白質的疏水部位結合,從而減弱蛋白質的疏水性吸附。根據這一原理,難溶于水的膜蛋白質可添加一定量的表面活性劑使其溶解,利用HIC法進行洗脫分離。但此時選用表面活性劑的種類和濃度應當適宜:濃度過小則膜蛋白不溶解,過大則抑制蛋白質的吸附。 (4)溫度
一般吸附為放熱過程,溫度越低吸附結合常數越大。但疏水性吸附與一般吸附相反,吸附結合作用隨溫度升高而增大。蛋白質疏水部位的失水有利于疏水性吸附,而失水是吸熱過程,即疏水性吸附為吸熱過程, ?0 因為: 所以吸附平衡常數K隨溫度的升高而增大。
2,蛋白質的分離
蛋白質與HIC填料之間的作用很復雜,有時不能完全用疏水性相互作用來解釋,有時配基苯環(huán)還會與蛋白質分子上的芳香族氨基酸產生?-?鍵。因此,在利用HIC分離蛋白質混合物時,需事先利用各種小型預裝柱進行吸附與洗脫實驗,確定**佳吸附劑和洗脫劑。 3,HIC的特點
HIC主要用于蛋白質類生物大分子分離純化。雖然HIC不如IEC應用昔遍,但可作為IEC的補充工具。如果使用方法適當,HIC具有與IEC相近的分離效率.歸納而言,H1C具有如下特點:
(1) 由于在高濃度鹽溶液中疏水性吸附作用較大,因此,HIC可直接分離鹽析后的蛋白質溶液; (2) 可通過調節(jié)疏水配基鏈長和密度調節(jié)吸附力,因此此可根據目標產物的性質選擇適宜的吸附劑;
(3) 疏水性吸附劑種類多,選擇余地大,價格與離子交換劑相當。 羥基磷灰石層析
羥基磷灰石(hydroxyapatite, HAP): 是一種磷酸鈣晶體,基本分子結構為 一般認為,HAP的吸附主要基于鈣高子和磷酸根離子的靜電引力,即在HAP晶體表面存在兩種不同的吸附晶面,各存在吸附點c點和P點,前者起陰離于交換作用,后者起陽離于交換作用.因此,在中性pH環(huán)境下酸性蛋白質(pI<7)主要吸附于c點,堿性蛋白質(PI>7)主要吸附于P點.利用磷酸鹽緩沖液(K2HP04+KH2PO4)為流動相洗脫展開時,磷酸根離子在c點競爭性吸附,交換出酸性蛋白質,而K+在P點競爭性吸附,交換出堿性蛋白質。所以HAP層 析通常以磷酸鹽緩沖液為流動相,采用提高鹽濃度的線性梯度脫法。 應用:
由于HAP晶體表面結構特別,吸附機理特殊,因此可用于識別DNA及RNA的單鏈和雙鏈,分離IEC和HIC難于分離的蛋白質物系。例如,人腫瘤壞死因子(human tumour necrosis factor,hTNF)的構成蛋白質分子差異很小, 利用IEC法、高效RPC法和電泳法只能得到一個洗脫峰或電泳帶,而利用HAP層析可分離得到4個洗脫峰。
HAP吸附劑價格便宜,遠低于高子交換劑,適用于大規(guī)模分離純化過程,已成為單克降抗體的主要純化手段。
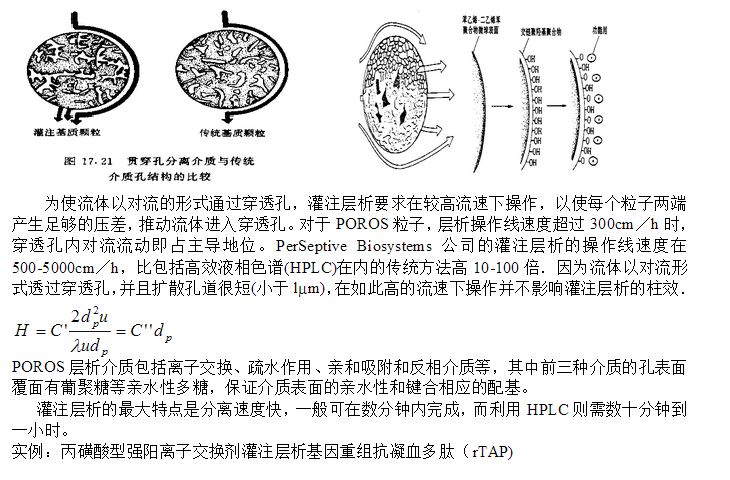
灌注層析(Perfusion chromatography)
灌注層析(Perfusion chromatography)是美*PerSeptive Biosystems公司于1989年開發(fā)的層析分離技術,Perfusion chromatography是該公司的注冊商標.灌注層析的關鍵是其以POROS命名的固定相粒子的特殊結構;POROS的基質是聚苯乙烯—二乙烯苯,含有兩種大小不同的孔道。大孔直徑為0.6 ~ 0.8?m,流體以對流形式通過,稱為穿透孔(throughpore); 小孔直徑與一般介質一樣,直徑500 ~ 1000 , 流體以擴散的形式通過,稱為擴散孔(diffusive pore).如圖所示,穿透孔之間以擴散孔相連,保證了
POROS介質的大比表面積和溶質吸附容量。同時,擴散孔道長度小于l?m,溶質擴散所需時間極短,大大降低了利用傳統(tǒng)介質進行層析分離的擴散傳質阻力。
吸附劑體積: 1.25 L (?25?252) 上樣液: 80ml,lmg rTAP/ml
沖洗:用相當于3倍柱體積的平衡液(0.1mol/L NaCl,0.05 mol/L富馬酸鈉,pH3.5)清洗 洗脫:用洗脫液(0.5mol/L NaCl,0.05mol/L富馬酸鈉,pH3.5)洗脫,第二個峰即為純化的rTAP,收率為93.4%。
層析聚焦(Chromatofocusing)
層析聚焦是基于離子交換的原理,根據兩性電解質分子間等電點的差別進行分離純化的洗脫層析法.
層析聚焦利用離子交換劑為固定相,因此是一種離子交換層析法。但是,與一般IEC所不同的是,層析聚焦利用在較寬pH值范圍內具有緩沖作用的多緩沖離子交換劑為固定相,同時利用在較寬pH值范圍內具有緩沖作用的多緩沖劑為流動相。所以,當向層析柱內通入與柱內初始pH值不同的多緩沖劑時,柱內pH值緩慢改變,在軸向形成連續(xù)的pH梯度,使料液中的溶質依據各自的等電點或者吸附,或者脫附,逐次向下移動,彼此之間得到分離。 多緩沖劑:
多緩沖劑是兩性電解質緩沖劑,由相對分子質量大小不一的各種多羧基多氨基化合物組成,存在各自的等電點。常用的多緩沖劑有Pharmacia公司生產的Polybuffer 96、Polybuffer 74和Pharmalyte等,緩沖pH范圍分別為pH 9-6,pH 7-4和pH 10.5-8。在相應的緩沖pH范圍內,各種多緩沖劑具有均衡的緩沖容量,在層析聚焦操作中提供平滑的pH梯度。 多緩沖離子交換劑: 可利用普通的凝膠過濾介質偶聯特殊的離子交換基制備.如Pharmacia公司生產的PBEll8和94即為以Sepharose 6B為載體的陰離子交換劑,前者與Pharmalyte 匹配使用,后者與Polybuffer96和Polybuffer 74匹配使用。 #p#分頁標題#e#
Pharmacia生產的另一種多緩沖離子交換劑為Mono P,其離于交換基為具有不同pKa值的弱堿性胺基.MonoP可與上述三種多緩沖劑匹配使用,粒徑僅10?m,用作高效層析聚焦柱的固定相。
層析聚焦的應用
層析聚焦需使用特殊的固定相和流動相,難于應用在大規(guī)模分離純化過程,主要用于生化實驗規(guī)模的樣品制備或成分分析.但作為一種蛋白質分離純化手段,層析聚焦的純化效率極高,峰寬可小到0.02 – 0.05pH單位,可分力電點差僅0. 02的蛋白質。
